Entre nos nossos canais do Telegram e WhatsApp para notícias em primeira mão.
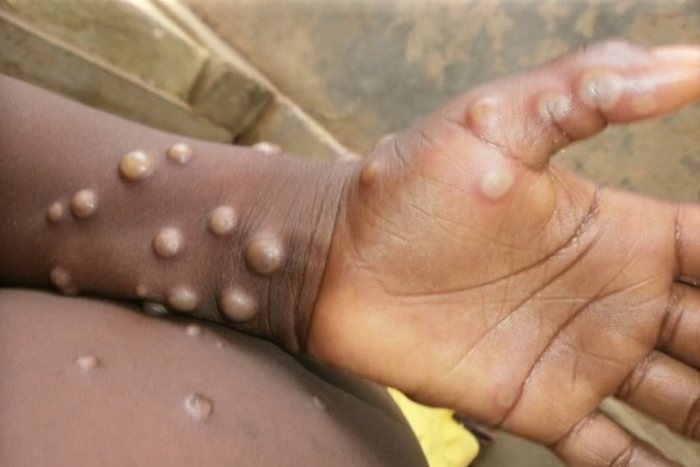
A Agência Nacional de Vigilância Sanitária (Anvisa) renovou a dispensa de registro sanitário das vacinas Jynneos e Imvanex, que foram adquiridas pelo Ministério da Saúde para a prevenção da mpox (varíola dos macacos).
A renovação foi oficializada nesta terça-feira (27) no Diário Oficial da União (DOU). Segundo a decisão unânime da diretoria colegiada da Anvisa, a renovação da dispensa de registro é excepcional e temporária, com validade de 180 dias a partir de 23 de agosto de 2024.
A vacina Jynneos é fabricada pela Bavarian Nordic, na Dinamarca, e a Imvanex é produzida pela IDT Biologika GmbH, na Alemanha.
De acordo com a Anvisa, ambos os imunizantes correspondem ao mesmo produto, com diferentes denominações nos Estados Unidos e na Europa.
No dia 15 de agosto, o Ministério da Saúde anunciou negociações para a aquisição emergencial de 25 mil doses de vacinas contra a mpox junto à Organização Pan-Americana da Saúde (Opas). A mpox foi declarada uma emergência em saúde pública de importância internacional.
Durante a primeira emergência global de mpox em 2023, a Anvisa autorizou o uso emergencial da vacina Jynneos, uma vez que o produto não era licenciado no Brasil. Esta autorização foi renovada em fevereiro deste ano, mas expiraria novamente em agosto.
A Anvisa informou que o imunizante é destinado a adultos a partir de 18 anos e possui um prazo de validade de até 60 meses quando armazenado em temperaturas entre -60°C e -40°C.
Na semana passada, o Centro de Tecnologia de Vacinas (CTVacinas) da Universidade Federal de Minas Gerais (UFMG) anunciou que está prestes a iniciar a última fase de desenvolvimento de uma vacina nacional contra a mpox, com os testes em humanos.
A equipe do CTVacinas está preparando o Dossiê de Desenvolvimento Clínico de Medicamento (DDCM) para submeter à Anvisa e obter a autorização para iniciar os testes clínicos.
O desenvolvimento da vacina brasileira ganhou relevância após a declaração de emergência global, embora o projeto já esteja em andamento há dois anos, desde a primeira emergência.